(1)肼(N
2H
4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN
2H
4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N
2H
4完全燃烧反应的热化学方程式是
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH溶液.肼-空气燃料电池放电时:正极的电极反应式是
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
.
Ⅱ:探究家庭制备次氯酸钠溶液的发生器如右图,原理是用石墨做电极电解饱和食盐水.
(1)若通电后,为使氯气被全部吸收,则电源的a极的名称是
负极
负极
.
(2)电解饱和食盐水的离子方程式为
,所得的次氯酸钠溶液中加入几滴石蕊试液,观察到的现象是
溶液先由紫色变蓝很快褪色
溶液先由紫色变蓝很快褪色
,用离子方程式和简要文字说明理由
ClO-+H2O?HClO+OH-,使溶液呈碱性,溶液由紫色变蓝,氯酸根离子具有强氧化性,所以随后溶液颜色褪去.
ClO-+H2O?HClO+OH-,使溶液呈碱性,溶液由紫色变蓝,氯酸根离子具有强氧化性,所以随后溶液颜色褪去.
.

 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
![]() (1)32.0克该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(在101kPa,25℃ ),则肼完全燃烧的热化学方程式 。
(1)32.0克该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(在101kPa,25℃ ),则肼完全燃烧的热化学方程式 。 ![]() (2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,正极的电极反应式是 。
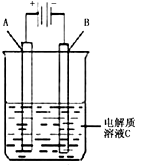
(2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,正极的电极反应式是 。 ![]() (3)右图是一个电化学装置示意图。用肼―空气燃料电池做此装置的电源。
(3)右图是一个电化学装置示意图。用肼―空气燃料电池做此装置的电源。 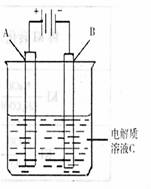
![]() ①如果A为含有锌、银、金等杂质的粗铜,
①如果A为含有锌、银、金等杂质的粗铜,![]() B为纯铜,C为CuSO4。通电一段时间后,A极质
B为纯铜,C为CuSO4。通电一段时间后,A极质![]() 量的减少将 B极质量的增加(填“等于”
量的减少将 B极质量的增加(填“等于” ![]() 或“大于”或小于)。
或“大于”或小于)。 ![]() ②如果A是铂电极,B是石墨电极,C是氯化钠溶液,
②如果A是铂电极,B是石墨电极,C是氯化钠溶液, ![]() 则若要制得11.2升Cl2气体(标况下),该燃料电池理
则若要制得11.2升Cl2气体(标况下),该燃料电池理 ![]() 论上需消耗 molN2H4。
论上需消耗 molN2H4。 ![]() (4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___________
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___________