
题目列表(包括答案和解析)
如图所示为条件一定时,反应2NO(g)+O2(g)
 2NO2(g) △H<0中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
2NO2(g) △H<0中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
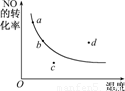
A.a B.b C.c D.d
)同温同压下,当反应物分解了8%时,总体积也增加8%的是
A.2NH3(g) ![]() N2(g)+3H2(g)
N2(g)+3H2(g)
B.2NO(g) ![]() N2(g)+O2(g)
N2(g)+O2(g)
C.2N2O5(g) ![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
D.2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
可逆反应:2NO2(g)  2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡
状态的标志是
①单位时间内生成nmol O2的同时生成2nmol NO2②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是
L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
| A.适当升高温度 | B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 | D.吸收塔内填充瓷环,增大气液接触面 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com