[化学-物质结构与性质]
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls
22s
22p
6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)上述六种元素中,
F
F
元素的原子的第一电离能最大,理由是:
其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
其最外层电子数为7,且原子半径小,容易得到电子,不容失去电子
.
(2)C元素原子的第一电离能
>
>
(填“>”“<”“=”)D,理由是:
Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构
.
(3)上述六种元素按电负性从小到大的排列是
Mg、Al、P、S、O、F
Mg、Al、P、S、O、F
.
(4)C、D、E、F元素形成的最高价氧化物分别是
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物
(填“离子”“共价”)化合物.
(5)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
H2SO4、H3PO4、Al(OH)3、Mg(OH)2
.

 [化学--有机化学基础]
[化学--有机化学基础]
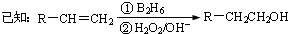
 -CH=CHCHO
-CH=CHCHO -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O

 →
→ -CH2COOH+HCl
-CH2COOH+HCl →
→ -CH2COOH+HCl
-CH2COOH+HCl 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.[已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O]
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.[已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O]