
题目列表(包括答案和解析)
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。
 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是 。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为 。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+= Cu+ Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式 。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:

某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。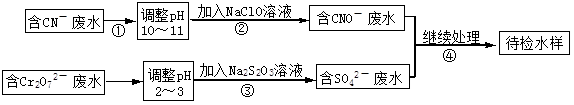 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
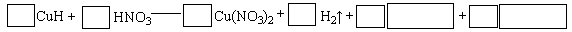
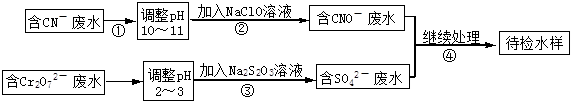 回答以下问题:
回答以下问题:| A.1 | B.1/2 | C.2 | D.不能确定 |
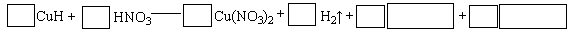
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法正确的是
KIO3+3H2↑。下列有关说法正确的是
A、电解时,石墨作阴极,不锈钢作阳极
B、电解液调节至酸性比较合适
C、电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D、电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体
近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为KI+H2O→KIO3+H2↑,下列有关说法中,正确的是
A、电解时因为有氢气生成,整个溶液的pH会增大
B、电解时,铁做阳极,石墨作阴极
C、电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D、电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com