
题目列表(包括答案和解析)
(7分)试回答下列(1)、 (2)两小题
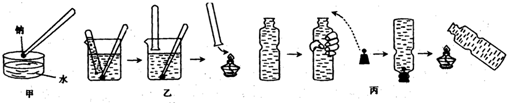
(1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 (填代号A、B……)
A.用托盘天平称取29.25g的食盐;
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
C.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
D.用湿润的pH试纸测得某溶液的pH为10
E.做中和滴定实验时,锥形瓶用待测液润洗
(7分)试回答下列(1)、 (2)两小题
(1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 (填代号A、B……)
A.用托盘天平称取29.25g的食盐;
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
C.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
D.用湿润的pH试纸测得某溶液的pH为10
E.做中和滴定实验时,锥形瓶用待测液润洗
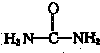 )与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为
)与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com