大量排放CO
2会加重温室效应,影响地球大气环境.为减少CO
2对环境的影响,世界各国在限制其排放量的同时加强了对CO
2创新利用的研究,如致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质,如甲醇、CH
4、汽油 等.
I.目前,用超临界CO
2(其状态介于气态和液态之间)代替氟利昂作致冷剂已经成为一种趋势,这一做法的积极意义在于
.
II.有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO
2从溶液中提取出来,经过化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
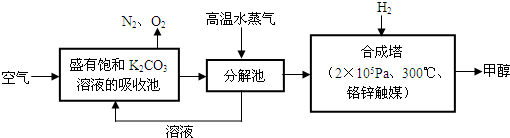
(1)吸收池中反应的化学方程式为:
.
(2)在合成塔中,若有4.4kgCO
2与足量H
2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式
.
(3)控制不同的反应条件,CO
2和H
2反应还可以得到其它有机物.如将CO
2和H
2以1:4的体积比混合,在适当条件下反应,可获得重要能源CH
4:CO
2+4H
2=CH
4+2H
2O;如将CO
2和H
2以1:3的体积比混合,还可生成某种重要的化工原料和水,该化工原料可能是
.
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(4)已知在443~473K时,用钴(Co)作催化剂可使CO
2和H
2生成C
5~C
8的烷烃,这是人工合成汽油的方法之一.要达到汽油的要求,CO
2和H
2体积比的取值范围应是
.
Ⅲ.若在一密闭恒容容器中充入CO
2和H
2的物质的量分别为1mol和3mol,发生反应得到CH
3OH(g)和H
2O(g).测得CO
2和CH
3OH(g)的浓度随时间变化如图所示:
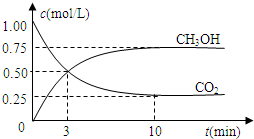
(1)从反应开始到平衡,氢气的平均反应速率v(H
2)=
mol/(L?min).
(2)下列措施中能使n(CH
3OH)/n(CO
2)增大的是
.
A.升高温度 B.充入He(g),使体系压强增大
C.将H
2O(g)从体系中分离 D.再充入1mol CO
2和3mol H
2.



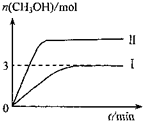 (2013?绵阳模拟)为减小C02对环境的影响,在倡导“低碳”的同时,还需加强对C02创新利用的研究.T1℃时,将9molC02和12molH2充入3L密闭容器中,发生反 应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为P1.改变某一条件重新进行上述反应,CH3OH的物 质的量随时间变化如曲线II所示.下列说法错误的是( )
(2013?绵阳模拟)为减小C02对环境的影响,在倡导“低碳”的同时,还需加强对C02创新利用的研究.T1℃时,将9molC02和12molH2充入3L密闭容器中,发生反 应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为P1.改变某一条件重新进行上述反应,CH3OH的物 质的量随时间变化如曲线II所示.下列说法错误的是( ) (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.