
题目列表(包括答案和解析)
向足量H2SO4溶液中加入100mL 0.4 mol?L―1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol?L―1 HCl溶液时,放出的热量为2.292kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式及中和热的有关叙述中正确的是( )
A.中和热△H=-57.3kJ?mol―1
B.稀的强酸与强碱反应的中和热为:△H=-128kJ?mol―1
C.Ba2+(aq)+SO42―(aq)=BaSO4(s);△H=-73kJ?mol―1
D.Ba2+(aq)+SO42―(aq)=BaSO4(s);△H=-13.4kJ?mol―1
向足量H2SO4溶液中加入100mL 0.4 mol?L―1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol?L―1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为:
A.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-2.92kJ?mol―1
B.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-0.72kJ?mol―1
C.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-73kJ?mol―1
D.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-18kJ?mol―1
(8分)“碘钟”实验中,3I-+![]() =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/ mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s~44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3 ~t4阶段为使用催化剂。下列说法正确的是 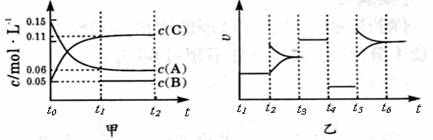
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol?L-1?s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g);ΔH=+100akJ?mol-1
B(g)+2C(g);ΔH=+100akJ?mol-1
反应2SO2+O2![]() 2SO3经一段时间后,SO3的浓度增加了0.4 mol?L-1,在这段时间内用O2表示的反应速率为0.04 mol?L-1?s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol?L-1,在这段时间内用O2表示的反应速率为0.04 mol?L-1?s-1,则这段时间为( )
A.0.1 s
B.2.5 s
C.5 s
D.10 s
一、1.B 2.A?
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D?
4.BC 5.B 6.B 7.D 8.BD?
9.解析:由①②组数据解得m=1,由②③组数据解得n= 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化剂 (3)> >
(4)吸热 温度升高时,平衡向右移动?
11.①
12.④>③=②>①?
13.
 (
( -x)?mol?L-1?min-1
-x)?mol?L-1?min-1
14.(1)1∶50 根据勒夏特列原理,通入过量而廉价的氧气,可提高SO2的转化率
(2)废气中每小时排出的SO2的体积为:1
(3)SO2 ~ 2NH3 ~ (NH4)2SO4?
 mol?
mol?
 mol
mol
 mol
mol
故可得(NH4)2SO4: mol×1
mol×1
消耗氨气: mol×2×1
mol×2×1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com