
题目列表(包括答案和解析)
| D | ||||
| W | ||||
某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
反应aX(g) +
bY(g)  cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )
cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )
A.a+b < c, Q > 0 B.a+b < c, Q < 0
C.a+b > c, Q > 0 D.a+b > c, Q < 0
在一定条件下,在密闭容器中进行的反应
aX(g)+bY(g)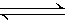 cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少
cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少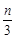 mol·L-1,Z增加
mol·L-1,Z增加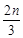 mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
A.1∶3∶1∶2 B.3∶1∶2∶2 C.3∶1∶2∶1 D.1∶3∶2∶2
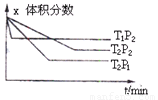
(6分)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
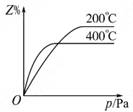
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填”增大”“减小”或”不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)。
A.X的转化率越高 B.反应进行得越完全
C.达到平衡时X的浓度越大 D.化学反应速率越快
(2)如图所示,相同温度下,在甲、乙两容器中各投入1 mol X、2 mol Y和适量催化剂,甲、乙两容器的初始体积均为1 L。甲、乙容器达到平衡所用时间:甲 乙(填”>““<“或”=“,下同),平衡时X和Y的转化率:甲 乙。
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
B
C
C
C
C
B
D
题号
11
12
13
14
15
答案
A
A
B
D
A
二、填空题:
16. 
 17. ①a;②c;③b。
17. ①a;②c;③b。
三、计算题:
18. 减小 , 不变; 减小 ; 不变 ;增加。
19. ⑴a=16 ⑵ n平(NH3) =8mol ⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com