
题目列表(包括答案和解析)
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
A.平衡向逆反应方向移动了 B. x+y>z
C.B的转化率下降 D.C的体积分数减小
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
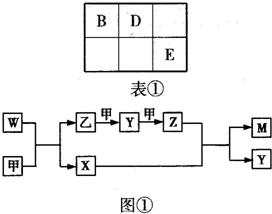 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中相对位置如表①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子.它们之间的转化关系如图①所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中相对位置如表①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子.它们之间的转化关系如图①所示.A、B、D、E 四种短周期元素,其原子序数逐渐增大。A 元素原子的核外电子数、电子层数和最外层电子数均相等,B、D、E 三种元素在周期表中相对位置如图①所示,E 的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z 七种物质均由A、B、D 三种元素中的一种或几种组成,其中只有M 分子同时含有三种元素;W 为A、B 两元素组成的18 电子分子,可做火箭燃料;甲、乙为非金属单质;X 分子含有10个电子。它们之间的转化关系如图②。

回答下列问题:
(1)Z的化学式为 。
(2)E 的单质与水反应的离子方程式为 。
(3)W—空气燃料电池是一种碱性燃料电池,电解质溶液是20% ~30%的KOH溶液。W—空气燃料电池放电时,负极反应式为 。
(4)将一定量的A2、B2 的混合气体放入2L密闭容器中,在500°C、2°C×107 Pa下达到平衡。测得平衡气体的总物质的量为0.5mol,其中A2 为0.3mol,B2 为0.1mol。则该条件下A2 的平衡转化率为 ,该温度下反应2BA3(g ) ![]() 3A2(g)+B2(g)的平衡常数为 。
3A2(g)+B2(g)的平衡常数为 。
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
 ,此时N2的转化率为 .
,此时N2的转化率为 . 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
B
C
C
C
C
B
D
题号
11
12
13
14
15
答案
A
A
B
D
A
二、填空题:
16. 
 17. ①a;②c;③b。
17. ①a;②c;③b。
三、计算题:
18. 减小 , 不变; 减小 ; 不变 ;增加。
19. ⑴a=16 ⑵ n平(NH3) =8mol ⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com