
题目列表(包括答案和解析)
| CuSO4 |
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
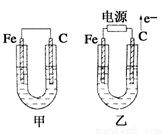
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒。
②乙池中阳极的电极反应式是_______________________。
(2)若两池中均为饱和NaCl溶液:
①甲池中碳极上电极反应式是________________________,乙池碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
②将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为_________。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=___。
(13分)如右图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的_____棒,乙池中的____棒。
②乙池中阳极的电极反应式是__ ___。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式___ _。
②甲池中碳极上电极反应式是__ ____,
乙池碳极上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,
反应的化学方程式为______ __。
④若乙池转移0.02 mol e-后停止实验,恢复至室温,池中溶液体积是200 mL,则溶液混合均匀后的PH=______。
(1)热敷袋放出的热量来源于____________放出的热量。
(2)炭粉的作用是________________________________________________。
(3)加入NaCl的作用是___________________________________________。
(4)写出有关的电极反应式和化学方程式____________________________。
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:

(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______________________________。
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为__________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com