
题目列表(包括答案和解析)
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| 1 |
| 2 |
| 1 |
| 2 |

| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
| 1 |
| 2 |
| 1 |
| 2 |
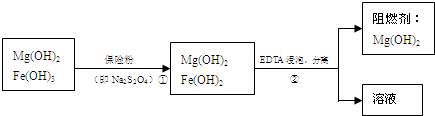
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度T/℃ | 加入EDTA质量(g) | 加入保险粉质量(g) | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |

| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
一、1.解析:Fe Fe2+
Fe2+ Fe3+
Fe3+ Fe(OH)3
Fe(OH)3 Fe2O3。
Fe2O3。
答案:A?
2.B 3.C?
4.解析:根据2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,还消耗2 mol Fe3+。
答案:C?
5.C 6.A 7.B 8.A 9.C 10.AD?
二、11.Fe2O3 CO和H2 Fe3O4、FeO?
12.(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO +8H+===3Fe2++2NO↑+4H2O?
+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
13.(1)Fe Cl2 H2?
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑?
(4)2FeCl2+Cl2===2FeCl3?
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略?
15.65 g 20.5%?
16.(1)ac?
(2)设Fe2O3原有n0 mol,还原百分率为A%,则有?


A%= ≈33.3%
≈33.3%
(3)3-
(4)Fe2O3、Fe3O4 8<a<9?
Fe3O4、FeO 6<a<8?
Fe2O3、Fe3O4、FeO 6<a<9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com