
题目列表(包括答案和解析)
 (2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(2012?西安一模)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
| 4×78g/mol |
| ag/cm3.6.02×1023/mol |
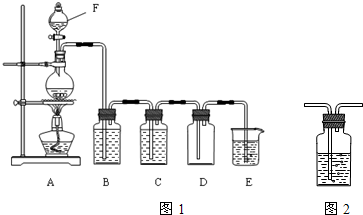
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.(15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |




一、1.B 2.D 3.D?
4.解析:FexOy+yCO xFe+yCO2?
xFe+yCO2?
(56x+16y) g y mol?
 mol
mol
得:x∶y=2∶3?
答案:B
5.AD 6.B 7.B 8.CD?
9.解析:A.如AlO B.如C+FeO
B.如C+FeO CO↑+Fe C.如Br-
CO↑+Fe C.如Br- Br2 D.如Fe3+
Br2 D.如Fe3+ Fe2+
Fe2+
答案:AD?
10.C?
二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。?
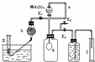
12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气?
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl?
注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。?
(3)ABE (必须全对给一分,错、漏一个即不给分)?
(4)加快氢气产生的速度?
(5)Fe3O4+4H2 3Fe+4H2O?
3Fe+4H2O?
(6)检验氢气的纯度 点燃氢气?
13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3?
(2)NaOH+NH4Cl NaCl+NH3↑+H2O?
NaCl+NH3↑+H2O?
2NH3+3CuO 3Cu+N2↑+3H2O?
3Cu+N2↑+3H2O?
14.(1)20.4% (2)BaO?Fe2O3?
15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com