
题目列表(包括答案和解析)
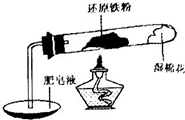 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
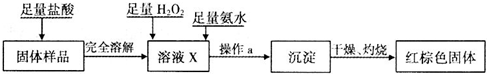
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
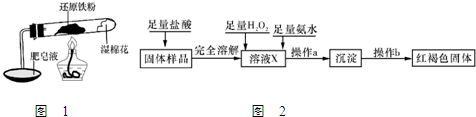
(12分)铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 0C 时,生成FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
![]() (1)实验中使用肥皂液的作用是 。
(1)实验中使用肥皂液的作用是 。
![]() (2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是 ;不能确定是否存在Fe3O4的原因是 。
![]() (3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
![]() ①溶液X中发生氧化还原反应的离子方程式为 。
①溶液X中发生氧化还原反应的离子方程式为 。

②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是 。
③确定是否存在Fe3O4需要测定并记录的实验数据是 。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |

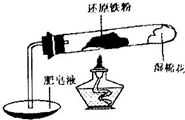 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com