
题目列表(包括答案和解析)
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是___ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S____(填“强”或“弱”)。气态SeO3分子的立体构型为____ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—而体现一元弱酸的性质,则[B(OH)4]—中B的原子杂化类型为 。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的离子方程式为 。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(已知lpm=10-12m,只要求列算式,不必计算出数值,阿伏加塞罗常数为NA)。

“立方烷”是新合成的一种烃,其分子为正立方体结构。
(1)“立方烷”的分子式是_______。
(2)“立方烷”可能有的结构是_______(从A、B、C、D中选)。
(3)“立方烷”可能发生的反应或变化有_______(从A、B、C、D中选)。
( )
A. 可使Br2水褪色,但不反应
B. 不能使溴的CCl溶液褪色
C. 能发生取代反应
D. 能发生加成反应
(4)有一个苯环的芳烃为“立方烷”的同分异构体,此芳烃能发生加聚反应,加聚反应的化学方程式为_______。
(1)“立方烷”的分子式是_______。
(2)“立方烷”可能有的结构是_______(从A、B、C、D中选)。
(3)“立方烷”可能发生的反应或变化有_______(从A、B、C、D中选)。
( )
A. 可使Br2水褪色,但不反应
B. 不能使溴的CCl溶液褪色
C. 能发生取代反应
D. 能发生加成反应
(4)有一个苯环的芳烃为“立方烷”的同分异构体,此芳烃能发生加聚反应,加聚反应的化学方程式为_______。
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: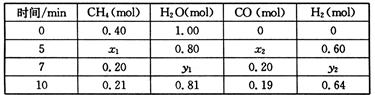
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
一、1.B 2.B 3.C 4.C 5.BD 6.C 7.D 8.C?
二、9.(1)C8H8 (2)B (3)ABC?

10.(1)A是冷凝管,B是蒸馏烧瓶,C是锥形瓶 (2)i;h;a;k;l;b;f;g;q (3)进水口 出水口 (4)蒸馏烧瓶支管口 (5)防止暴沸 (6)溶剂油和汽油 煤油?
11.(1)蒸馏烧瓶(或圆底烧瓶),温度计,冷凝管,锥形瓶 沸石(或碎瓷片)?
(2)如下图?

12.(1)③ (2)甲烷 ② (3)③ 氢气的输送和贮存?
13.C5H10
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com