
题目列表(包括答案和解析)
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
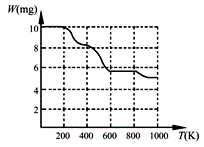
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组分别从定性和定量两方面对此作了研究。
定性实验:按图组装好实验装置,微热试管A,观察实验现象。反应开始后,观察到A试管中Zn与浓硫酸反应,C、D、E中有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失。反应较长时间后,C、D、E中的气泡量又会明显增加。试回答下列问题: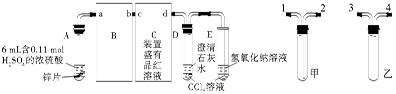
(1)从甲、乙装置选择合适的填入B、C中,并进行正确连接,a接 、 接b,c接 、 接d;D、E两支试管中CCl4的作用是 。
(2)能证明浓硫酸具有强氧化性的实验现象为 ;反应较长时间后气泡量又会明显增加的原因是 。
(3)一定量的浓硫酸与足量Zn充分反应时,有H2生成的理由是 ;实验过程中,浓硫酸表现强氧化性的反应方程式是 。D中浑浊消失的离子反应方程式是 。
定量实验:某化学实验研究性学习小组设计了以下实验,以定量测定反应中生成的SO2和H2的体积之比。
取A试管中充分反应后的溶液2 mL(假设反应前后溶液的体积不变),配制成100 mL溶液。然后取稀释液20.00 mL滴加BaCl2溶液使沉淀完全,过滤、洗涤、干燥沉淀,称量所得沉淀为1.4 g。
(4)完成定量实验部分所需的玻璃仪器有:滴管、玻璃棒、烧杯、量筒、干燥器、 、 、 、 、 等(可填满,也可以空缺)。
(5)计算反应中生成的SO2和H2的体积之比: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com