
题目列表(包括答案和解析)
①CH3CH2CH3:Ω=0;②(CH3)2CH—:Ω=0;③CH2=CHCH2—:Ω=1; ④![]() :Ω=1;⑤C8H15—:Ω=1;⑥
:Ω=1;⑤C8H15—:Ω=1;⑥![]() :Ω=2;⑦
:Ω=2;⑦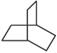 :Ω=2; ⑧CH3C≡CCH2CH=CH2:Ω=3;⑨CH3(CH=CH)3CH3:Ω=3;⑩
:Ω=2; ⑧CH3C≡CCH2CH=CH2:Ω=3;⑨CH3(CH=CH)3CH3:Ω=3;⑩![]() :Ω=4。
:Ω=4。
(1)请写出下列各烃分子的Ω。
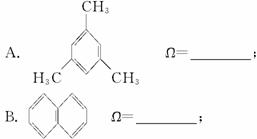
C.立方烷:![]() (正立方体的每个顶点上有一个碳原子,每个碳原子上有一个氢原子) Ω=____________。
(正立方体的每个顶点上有一个碳原子,每个碳原子上有一个氢原子) Ω=____________。
(2)请写出下列烃基的Ω。
D.![]() (2价基团) Ω=_______________;
(2价基团) Ω=_______________;
E.![]() (3价基团) Ω=__________________;
(3价基团) Ω=__________________;
F. ![]() (2价基团) Ω=_________。
(2价基团) Ω=_________。
(10分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍,又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。
请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后,消耗后者的物质的量为 。
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(3)单质B的燃烧热为a kJ/mol。由B、C两种元素组成的化合物BC 14g完全燃烧放出bkJ热量,写出单质B和单质C反应生成BC的热化学方程式
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是
A、达到平衡所需要的时间:Ⅰ>Ⅱ B、达到平衡后A2C的转化率:Ⅰ=Ⅱ
C、达到平衡后BC的物质的量:Ⅰ>Ⅱ D、达到平衡后A2的体积分数:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是 。
(10分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍,又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。
请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后,消耗后者的物质的量为 。
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(3)单质B的燃烧热为a kJ/mol。由B、C两种元素组成的化合物BC 14g完全燃烧放出bkJ热量,写出单质B和单质C反应生成BC的热化学方程式
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是
A、达到平衡所需要的时间:Ⅰ>Ⅱ B、达到平衡后A2C的转化率:Ⅰ=Ⅱ
C、达到平衡后BC的物质的量:Ⅰ>Ⅱ D、达到平衡后A2的体积分数:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是 。
| ||
| ||
| 3 |
| 4 |
| ||
| △ |
| ||
| △ |
(一)选择题
1.D 2.C 3.C 4.D 5.C 6.D 7.B、C 8.B 9.C 10.A 11.B 12.C、D 13.C、D 14 .B、C 15.B 16.D 17.D 18.D 19.B 20.C 21.A 22.A、B 23.B 24.D 25.D
(二)非选择题
1.答案为有机物的推断.files/image260.jpg)
2.(1)(A)4 (B)7 (C)5 (2)(D)4 (E)4 (F)2
3.(1)N2H4, 有机物的推断.files/image261.gif)
(2)H2N-NH2+H2O有机物的推断.files/image262.gif) H2N-NH2?H2O
H2N-NH2?H2O
H2N-NH2?H2O+H2O有机物的推断.files/image262.gif) H2O?H2N-NH2?H2O
H2O?H2N-NH2?H2O
4.(1)NxHy+有机物的推断.files/image121.gif) O2
O2有机物的推断.files/image123.gif)
有机物的推断.files/image264.gif) N2+
N2+有机物的推断.files/image125.gif) H2O (2)N2H4
H2O (2)N2H4
5.(1)略 (2)14.7 (3)NOx(或NO、NO2)、CO.
6.(1)23.3% (2)1.26×1018kJ (3)A=[有机物的推断.files/image267.gif) ×6×
×6×有机物的推断.files/image269.gif) Q为每生成1 mol葡萄糖所需要吸收的能量(或:每消耗6 mol CO2所需吸收的能量)
Q为每生成1 mol葡萄糖所需要吸收的能量(或:每消耗6 mol CO2所需吸收的能量)
7.(1)b、c、b、c、b (2)NaOH―CH3CH2OH溶液、加热
(3)有机物的推断.files/image270.gif)
8.(1)甲酸甲酯,HCHO,有机物的推断.files/image272.gif)
(2)CH3COONa+NaOH有机物的推断.files/image190.gif) Na2CO3+CH3↑
Na2CO3+CH3↑
(3)有机物的推断.files/image274.gif) (或
(或 有机物的推断.files/image276.gif) ,
,
有机物的推断.files/image278.gif)
有机物的推断.files/image280.gif)
9.(1)3∶2∶3 (2)有机物的推断.files/image282.jpg)
10.(1)CH2O (2)30,60;CH2O,C2H4O2
有机物的推断.files/image284.jpg)
有机物的推断.files/image286.jpg)
14.(1)乙二醇,乙二酸
(2)①,②,④ (3)②,④
(4)有机物的推断.files/image288.gif)
有机物的推断.files/image290.jpg)
17.(1)有机物的推断.files/image292.gif) 40%
40%
(2)CH3CH2CH2CHO,(CH3)2CHCHO,有机物的推断.files/image294.gif)
(3)CH2=CHCH(CH3)2
18.(1)2ClCH2COO?-2e有机物的推断.files/image123.gif) ClCH2CH2Cl+2CO2
ClCH2CH2Cl+2CO2
2H2O+2e有机物的推断.files/image123.gif) H2+2OH-
H2+2OH-
(2) 有机物的推断.files/image296.gif)
(3) 有机物的推断.files/image298.gif)
有机物的推断.files/image300.gif)
? 有机物的推断.files/image302.gif) ?n
?n
19.(1)CaC2+2H2O有机物的推断.files/image123.gif) Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
(2)CH≡CH+H2有机物的推断.files/image123.gif) CH2=CH2
CH2=CH2
(3)CH2=CH2+HCl有机物的推断.files/image123.gif) CH3CH2Cl
CH3CH2Cl
有机物的推断.files/image303.gif)
20.(1)n(C)=0.160(mol) n(H)=0.120(mol) n(O)=0.08(mol)
(2)最简式为C4H3O2.
(3)有机物的推断.files/image304.gif)
21.(1)4
(2)C4H6O4 (3)5, 有机物的推断.files/image306.gif)
(4)CH3OH, C2H5OH,H2O
22.A:CH―CH3―CH3,B:CH2―CH3―CH2OH,C:CH3CH2―O―CH3;A∶B∶C=1∶3∶6
|
OH
O
‖
23.(1)CH4,CH3―C―CH3
(2)CH2=C―COOH+CH3OH有机物的推断.files/image308.gif) CH2=C―COOCH3+2H2O
CH2=C―COOCH3+2H2O
| |
CH3 CH3
(3)加成,取代
COOCH3
|
(4)nCH2=C-COOCH3有机物的推断.files/image123.gif) ?CH2―C?n
?CH2―C?n
| |
CH3 CH3
24.(1)CxHy+(有机物的推断.files/image310.gif) )O2
)O2有机物的推断.files/image123.gif) mCO2+
mCO2+有机物的推断.files/image125.gif) H2O+(x-m)CO (2)C4H8
H2O+(x-m)CO (2)C4H8
(3)
分子式
n(CO)∶n(CO2)
C3H8
1∶2
C4H6
1∶3
O
‖
25.(1)(略) (2)缩聚nCH3 ―CH―COOH有机物的推断.files/image313.gif) H?O―CH―C?n―OH+(n-1)H2O
H?O―CH―C?n―OH+(n-1)H2O
| |
OH OH
O
‖
(3)H?O―CH―C?nOH+(n-1)H2O有机物的推断.files/image308.gif) nCH3―CH―COOH
nCH3―CH―COOH
| |
OH OH
有机物的推断.files/image315.gif)
26.(1)6CO2+12H2O有机物的推断.files/image317.gif) C6H12O6+6H2O+6O2
C6H12O6+6H2O+6O2
(2)C+O2=CO2
CnH2n+2+有机物的推断.files/image319.gif) O2
O2有机物的推断.files/image123.gif) nCO2+(n+1)H2O
nCO2+(n+1)H2O
CH4+2O2=CO2+2H2O
CH4产生的CO2最小,对环境负面影响最小
27.(1)C9H10O2 (2)4
有机物的推断.files/image320.gif)
28.(1)O=C=C=C=O
O O
‖ ‖
(2)C3O2+2HCl有机物的推断.files/image123.gif) Cl―C―CH2―C―Cl]
Cl―C―CH2―C―Cl]
O O
‖ ‖
C3O2+有机物的推断.files/image123.gif) C2H5―C―CH2―C―OCH2
C2H5―C―CH2―C―OCH2
29.(1)C15H13O
有机物的推断.files/image322.jpg)
30.(1)A,B;C,F;D,E (2)都有18O标记。因为反应中间体在消去一分子H2O 时,有两种可能,而乙氧基(OC2H5)是保留的。
有机物的推断.files/image324.jpg)
(3)有机物的推断.files/image326.gif) (或答中间体) ,因为这个碳原子连有4个原子团。
(或答中间体) ,因为这个碳原子连有4个原子团。
31.(1)C6H5―CH―NH―CO―C6H5+H2O有机物的推断.files/image308.gif) C6H5―CH―NH2+C6H5COOH
C6H5―CH―NH2+C6H5COOH
| |
HO―CH―COOH HO―CH―COOH
(2)α (3)C31H38O11
32.(1)0.125;0.30;0.100;5:12:4
(2)可以;因为该最简式中H原子个数已经饱和,所以最简式即分子式C5H12O4
(3)C(CH2OH)4
33.(1)十肽 (2)4个谷氨酸 (3)3个苯丙氨酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com