
题目列表(包括答案和解析)
| A、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 | B、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 | C、酸式滴定管未用标准盐酸溶液润洗 | D、把氢氧化钠待测液移入锥形瓶中时,有少量碱液溅出 |
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.配制NaOH溶液时,NaOH固体中混有少量KOH固体
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:

(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
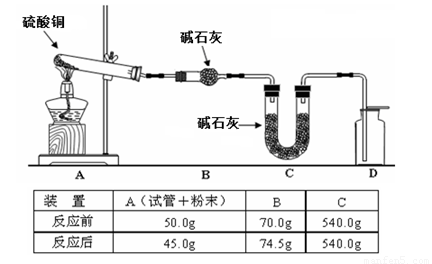
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
1.C 2.A、C 3.D 4.C 5.B、D 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本题考查学生称量、加热、溶解、结晶等基本操作,同时要求理论联系实际确定有关化学方程式和计算溶解度.
通过计算知:用50 mL 70℃热水与24 gKCl制几乎饱和的溶液,再用25 mL 70℃热水与 配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出
配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出 晶体,至20℃时,减压过滤使
晶体,至20℃时,减压过滤使 分离出来.
分离出来.
24.(1)无机酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易挥发的反应物:a;b
(4)用足量水洗涤,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出;使漏斗内外空气相通以保证(G)操作时漏斗里液体能够流出.
(3) 与水不互溶;而且碘在
与水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)热裂汽油中含有不饱和气态烃如丙烯、丁烯与溴发生加成反应.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止碱液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)试样质量=碳元素质量+氢元素质量为烃
试样质量>碳元素质量+氢元素质量为烃的含氧衍生物
(3)B
28.(1)
(2)碱石灰;无水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放热;反应开始后断开电键K,铂丝能继续保持红热.
;放热;反应开始后断开电键K,铂丝能继续保持红热.
(5)气体颜色变浅; 发生反应:
发生反应:

 ,属于放热反应,达到平衡后,若降低温度,平衡向右移动,
,属于放热反应,达到平衡后,若降低温度,平衡向右移动, 浓度减少,
浓度减少, 浓度增大,而
浓度增大,而 无色,所以气体颜色变浅.
无色,所以气体颜色变浅.
29.本题考查学生乙炔的制取方法、干燥、氧化原理及产物的吸收测定顺序.由于制得的乙炔气含水对燃烧及产物测定有影响,故制得的乙炔气体必须先干燥,然后再进行题中的催化氧化,乃至测定产物的质量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃烧产生的 气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
(3)

(4)
30.解析:过程如下:


答案:①将废水过滤,目的是除去其中的悬浮泥沙等不溶物;
②往①的滤液中加入足量锌粉,将其中的 置换出来;
置换出来;
③过滤②中的不溶物,滤出Ag和过量的锌粉;
④往③的滤渣中加入过量的稀硫酸,使其中的锌粉转化为 而进入溶液;
而进入溶液;
⑤过滤,将④中没溶解的Ag滤出回收;
⑥将③、⑤得到的滤液合并,蒸发浓缩,使 析出后回收.
析出后回收.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com