
题目列表(包括答案和解析)
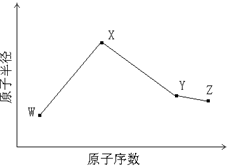 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
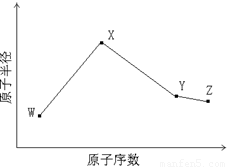
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 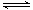 2A(g)
△H =-92.4 kJ・mol―1
2A(g)
△H =-92.4 kJ・mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
|
时间 |
浓度(mol/L) |
||
|
c(W2) |
c(B) |
c(A) |
|
|
第0 min |
4.0 |
9.0 |
0 |
|
第10min |
3.8 |
8.4 |
0.4 |
|
第20min |
3.4 |
7.2 |
1.2 |
|
第30min |
3.4 |
7.2 |
1.2 |
|
第40min |
3.6 |
7.8 |
0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) = ;
②反应在第10min改变了反应条件,改变的条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A 的浓度
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。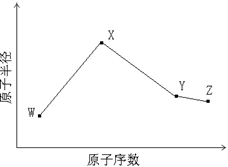
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 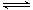 2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
X、Y、Z、W、R、Q六种短周期元素原子序数依次增大,Y、R、Q三种元素在周期表中相对位置如下:
请填写下列空白:
(1)若Y与Q形成的液体化合物是常见的重要有机溶剂。则Y、Q两种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示以下同) 。
(2)若化合物WQ是海水中的主要成分。等浓度的WQ与NH4Cl的混合液,其离子浓度由大到小的顺序为 。
(3)若Z、R是同一主族元素且X、Z、R位于不同周期。写出均含X、W、Z、R四种元素的两种化合物相互间发反应生成气体的离子方程式: 。
(4)若A是Y元素组成的单质,能发生如右图所示转化,工业上通过在高温下置换反应c制取非金属单质D,C是Z和Y的化合物,B、D在现代信息技术上有着重要用途。则反应c的化学方程式: 。
(5)由X、Y两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成水蒸气时所释放的能量为50.125kJ,已知H2O(l)= H2O(g), ΔH = +44 kJ/mol
请写出表示其燃烧热的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com