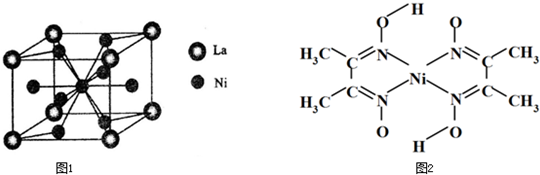
CO不仅是家用煤气的主要成分,也是重要的化工原料.美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等.如图所示:

图中G(RCOOR*)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物.已知D由CO和H
2按物质的理之比为1:2完全反应而成,其氧化产物可发生银镜反应:H是含有4个碳原子的化合物.试写出:
(1)结构简式:E
CH2=CHCOOH
CH2=CHCOOH
、G
CH2=CHCOOCH3
CH2=CHCOOCH3
.
(2)G的两个同类别同分异构体的结构简式
HCOOCH2CH=CH2
HCOOCH2CH=CH2
、
CH3COOCH=CH2
CH3COOCH=CH2
.
(3)G的同分异构体中核磁共振氢谱只有一种的结构简式
CH3COCOCH3
CH3COCOCH3
.
(4)反应类型:X
加成反应
加成反应
Y
消去反应
消去反应
.
(5)写出下列转化的化学方程式:
①A+CO+H
2O
E; ②F+D
H.
①
.
②
CH
3CH
2COOH+CH
3OH
CH
3CH
2COOCH
3+H
2O
CH
3CH
2COOH+CH
3OH
CH
3CH
2COOCH
3+H
2O
.


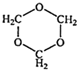



 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有