
题目列表(包括答案和解析)
|
对于可逆反应X(气)+3Y(气) | |
| [ ] | |
A. |
v(Y)=0.6 mol/(L·min) |
B. |
v(Y)=0.02 mol/(L·s) |
C. |
v(X)=0.01 mol/(L·s) |
D. |
v(Z)=1.0 mol/(L·min) |
对于可逆反应X(气)+3Y(气)![]() 2Z(气),下列各项所表示的反应速率,最快的是( )
2Z(气),下列各项所表示的反应速率,最快的是( )
A.v(Y )= 0.6 mol/(L· min) B. v(Y )= 0.02 mol /(L·s)
C.v(X )= 0.01 mol/(L·s) D. v(Z) = 1.0 mol/(L· min)
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙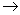 丁+己,甲+丙
丁+己,甲+丙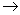 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
A.元素X在周期表中的位置为第2周期ⅥA族
B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X)
C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023
D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
| A.元素X在周期表中的位置为第2周期ⅥA族 |
| B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X) |
| C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 |
| D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol |
已知X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.

请根据信息回答有关问题:
(1)元素Y的原子核外共有________种不同运动状态的电子,有________种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)________.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)________.
(4)R的最高化合价为________.R的一种配合物的化学式为RCl3·6H2O.已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀.此配合物最可能是________.
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O
D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)________,配位体为(写化学式)________,x的值为________.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com