
题目列表(包括答案和解析)
| 1 | 4 |
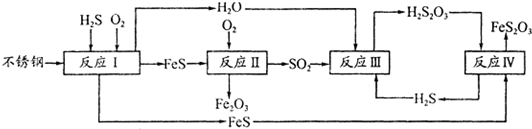
中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
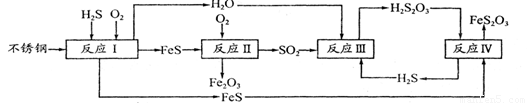
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s)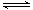 H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2 S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2 S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s) △H1=-2.5akJ·mol-1
S(s)+O2(g)=SO2(g) △H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-6akJ·mol-1
则反应II的热化学方程式为_____
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该 溶液中电荷守恒式为_____ ;反应IY的反应类型为______ ;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________
(分)A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1:1和1:2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com