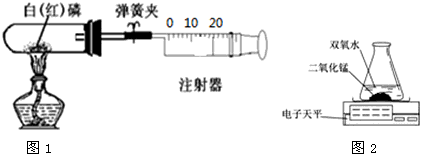
(一) 某化学兴趣小组的同学对教材中“测定空气里氧气含量”的实验做了改进,在密闭容器里进行磷的燃烧,以防止产生的白烟污染空气.他们设计了如图1所示实验:选用容积为50mL的试管作反应容器,选用50mL的注射器(开始时活塞处于20mL刻度处)来测量磷燃烧时所消耗氧气的体积.
I.实验操作步骤如下:
①检查装置的气密性.
②装入药品,连接好仪器.
③夹紧弹簧夹,加热白磷,观察现象.
④等燃烧结束,试管冷却后打开弹簧夹,观察现象.
II.实验现象记录:
在步骤③中加热时观察到白磷燃烧,产生
白烟
白烟
.活塞开始时向
不
不
移动(填“左”或“右”或“不”).
在步骤④中待装置冷却后,打开弹簧夹,观察到活塞慢慢向
左
左
移动(填“左”或“右”),最终停在约
10
10
mL刻度处(取整数值).
Ⅲ.实验结论:氧气占空气的体积分数约为
.
(二)另有化学兴趣小组的同学对实验室制备氧气的条件进行探究.
Ⅰ.为探究不同催化剂对氯酸钾分解速率的影响,甲组设计了以下两个对比实验:在相同的温度下,比较两组实验产生O
2的快慢.
①将3.0g KClO
3与1.0g MnO
2均匀混合加热.
②将x g KClO
3与1.0g CuO均匀混合加热.
(1)试写出实验①中所发生反应的化学方程式
;
(2)实验②中x的值应为
3.0
3.0
.
Ⅱ.为探究是否使用催化剂对双氧水(H
2O
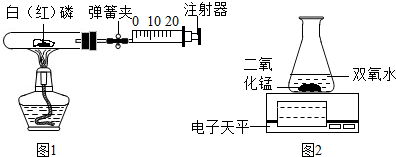
2)分解速率的影响,乙组采用如图2装置,进行有催化剂和无催化剂时的对比实验.
实验中应记录的数据主要是反应时间和
电子天平示数
电子天平示数
,可以通过比较单位时间内在
锥形瓶
锥形瓶
中(填仪器名称)的物质质量变化的多与少,达到实验目的.
Ⅲ.为探究的双氧水(H
2O
2)浓度对其分解速率的影响,丙组设计了以下实验.实验
数据记录如下:
| 序号 |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2体积 |
| ① |
50.0g |
1% |
0.1g |
9mL |
| ② |
50.0g |
2% |
0.1g |
16mL |
| ③ |
50.0g |
4% |
0.1g |
31mL |
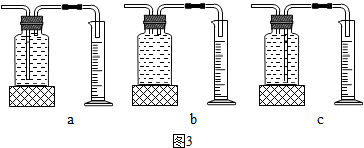
(1)丙组实验中,测量O
2体积的装置应选用
c
c
(填如图3中的字母编号).
(2)丙组实验获得的结论:在相同条件下,
双氧水的浓度越大
双氧水的浓度越大
,双氧水分解得越快.