
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||

| ||
| ||
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
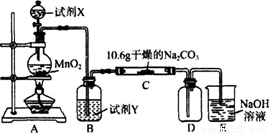
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
|
步骤2:向A试管中滴加______________: |
①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
|
步骤3:向B试管中滴加______________: |
若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
(4)己知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=___________(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有______________________。
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。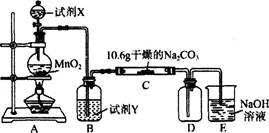
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加______________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加______________: | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
某化学活动小组利用如下装置对原电池进行研究,请回答下列问题(其中盐桥为含有KCl溶液的琼脂).
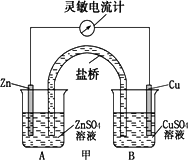

(1)、在甲图装置中,当电流计指针发生偏转时,盐桥中的离子移动方向为:K+移向________烧杯,Cl-移向________烧杯(填A或B),装置中电子转移的方向为:________.
(2)、如果将盐桥换成Cu导线(如乙图),该小组同学发现电流表指针仍然发生偏转,则C中可以构成________池,D中可以构成________池.
(3)、对乙图产生电流的原因猜想如下:
猜想一:ZnSO4溶液水解显酸性,如该观点正确,则C中铜导线上的电极反应式为:________.
猜想二:ZnSO4溶液酸性很弱,由于溶解了空气中的氧气而产生电流,如该观点正确,此时C中铜导线上的电极反应式为:________.
若猜想二正确,则可利用此原理设计电池为在偏远的海岛工作的灯塔供电,其装置以金属铝和石墨为电极,以海水为电解质溶液,试写出该电池工作时总反应的化学方程式________.
题号
1
2
3
4
5
6
7
8
9
10
11
答案
B
D
A
C
C
A
题号
12
13
14
15
16
17
18
19
20
21
答案
D
B
26.(1)ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。 (4分)
(2)关闭、打开; k 、m; 2CH3CH2OH+O2化学部分.files/image020.gif) 2CH3CHO+2H2O。 (6分)
2CH3CHO+2H2O。 (6分)
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出; 氢氧化钠吸水,促使氨放出; 氢氧化钠电离出的OH-增大了OH-浓度,促使氨水电离平衡左移,导致氨气放出。(3分)②还原。(1分) (共4分)
27.(1)Na Si P(6分)(2)化学部分.files/image022.jpg) (2分)
(2分)
(3)Al(OH)3+OH-====化学部分.files/image024.gif) +2H2O(2分)(4)原子 4n(4分)
+2H2O(2分)(4)原子 4n(4分)
28.(1)①CuCl2 (2分)酸性(1分)Cu2++2H2O Cu(OH)2+2H+(2分)
②离子键和极性共价键(2分)
(1分)
(2)3Cu+8H++2NO化学部分.files/image026.gif) =3Cu2++2NO↑+4H2O(2分)
=3Cu2++2NO↑+4H2O(2分)
(3)1(2分) (4)H2-2e-+2OH-=2H2O(2分)
29.⑴ a、b、e ⑵ ① 加成 ② 3
化学部分.files/image027.gif) |
⑶①
②
化学部分.files/image028.gif)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com