
题目列表(包括答案和解析)
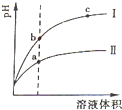
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ | 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol?L-1的醋酸溶液 | 0.1mol?L-1的NaOH溶液 |
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
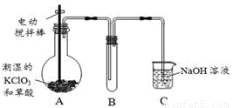
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:??????????????????????????? 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、??????????????? ;
B装置必须放在冰水浴中,其原因是??????????????????????????????? 。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①???????????????????? ;②??????????????????? ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)
①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:???????????????????????? 。
②滴定过程中至少需进行两次平行测定的原因是???????????????????????????????? 。
③写出步骤2中发生反应的离子方程式?????????????????????????????????? 。
④原ClO2溶液的浓度为???????????????? g / L(用步骤中的字母代数式表示)。
⑤若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果????????????? 。
若滴定开始仰视读数,滴定终点时正确读数,则测定结果?????????????????? 。
(填“偏高”“偏低”或“不变” )
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。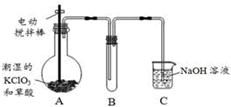
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;
B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知2 Na2S2O3+ I2=Na2S4O6+ 2NaI)
①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中至少需进行两次平行测定的原因是 。
③写出步骤2中发生反应的离子方程式 。
④原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
⑤若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。
若滴定开始仰视读数,滴定终点时正确读数,则测定结果 。
(填“偏高”“偏低”或“不变” )
生物答案
1
2
3
4
5
C
D
A
B
B
30. (1)植物组织培养(2分) 取根尖分生区制成装片,显微观察有丝分裂中期细胞内 同源染色体数目。若观察到同源染色体增 倍,则属染色体组加倍所致;否则可能为基 因突变所致(3分)
(2)选用多株阔叶突变型石刁柏雌、雄相交。若杂交后代出现了野生型,则为显性突变所 致;若杂交后代仅出现突变型,则为隐性突 变所致(5分)。
(3)选用多对野生型雌性植株与突变型雄性植株作为亲本杂交。若杂交后代中野生型全为雄株,突变型全为雌株,则这对基因位于x染 色体上;若杂交后代中野生型和突变型雌、 雄均有,则这对基因位于常染色体(5分)。
(4)已进化,生物进化的实质在于种群基因频率 的改变。(1分)
(6分)(1)双链mRNA不能与核糖体结合,从而不能合成酶b(2分);而细胞能正常合成酶a(1分),故生成的油量比例高
(2)基因通过控制酶的合成从而控制生物的新陈代谢(3分)
31.(20分)
(1)实验假设:一定浓度(或0.1mg/L)的萘乙酸溶液对种子的萌发有促进(或抑制)作用。(2分)只写出“一定浓度(或0.1mg/L)的萘乙酸溶液对种子的萌发有影响”不给分。
(2)第一步:取两个小烧杯,编号。在1号烧杯和2号烧杯中分别加入等量且适量的0.1mg/L的萘乙酸溶液和蒸馏水。(2分)
第三步:将两个培养皿编号,1号培养皿内的滤纸用0.1mg/L的萘乙酸溶液浸湿,2号培养皿内滤纸用蒸馏水浸湿。(2分)将从1、2号烧杯中取出等量(例如各20粒)的种子,分别放入与之对应的培养皿中,均匀摆放。(2分)
第四步:进行观察,统计种子萌发的数量。(2分)
(3)预测可能的实验结果:
①1号培养皿萌发种子数多于2号培养皿,说明0.1mg/L的萘乙酸溶液对种子的萌发有促进作用。(2分)
②1号培养皿萌发种子数少于2号培养皿,说明0.1mg/L萘乙酸溶液对种子的萌发有抑制作用。(2分)
③1号培养皿萌发种子数等于2号培养皿,说明0.1mg/L的萘乙酸溶液对种子的萌发没有作用。(2分)
(4)防止水分挥发,使萘乙酸浓度升高,影响实验结果(2分)
(5)多设计几个不同浓度的实验组,作为相互对照。即分别配制0.01mg/L、0.05mg/L、0.1mg/L、0.5mg/L、1mg/L的不同浓度梯度的萘乙酸溶液,重复上述实验步骤。(2分)
 解析:对该实验题的解答要明确生长素及生长素类似物的生理作用。要注意在设计实验的过程中,要科学的设计实验方法以及保持单一变量和实验对照原则。
解析:对该实验题的解答要明确生长素及生长素类似物的生理作用。要注意在设计实验的过程中,要科学的设计实验方法以及保持单一变量和实验对照原则。
理综考试化学答案
6.A 7. D 8.C 9.A 10.B 11.D 12.C 13.B
26.(共18分,每空2分)
(1)O2-(2分) O22-(2分)
(2)甲烷(2分) H―O―H(2分)
(3)①D(2分) ②=(2分) 0.0025(2分), ③0.10(2分) ④57.5(2分)
27. (每空2分,共14分)
(1) Fe3O4 电子式:略
|