
题目列表(包括答案和解析)
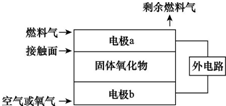 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电池的有关说法正确的是( )
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电池的有关说法正确的是( )固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是

A.电极b为电池负极,电极反应式为O2+4e-=2O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,接触面上发生的反应为:H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
固体氧化物燃料电池(SOFC)以固体氧化物(O2-可以自由通过)作为电解质。其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
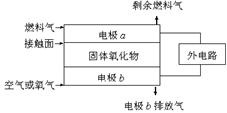
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为:H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
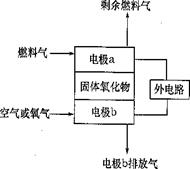 (2)假设外电路是电解硫酸铜溶液的装置。
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
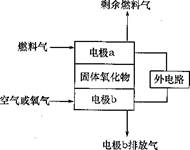 电解质介质,其工作原理如图所示。
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
一、单项选择题
1.D 2.C 3.B 4.C 5.D 6.C 7.A 8.B
二、不定项选择题
9.D 10.BC 11.D 12.AC 13.CD 14.A
三、非选择题(本题包括6小题,共60分)
15.(12分)
(1)500mL容量瓶 (1分)、玻璃棒(1分) 淀粉溶液 (1分)
(2)碱式(2分) 滴入最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复。(2分)(3)为保证I-全部转化为I2,所加氧化剂应稍过量。如果选用新制氯水或KMnO4作氧化剂,则过量的这些氧化剂在滴定时会氧化硫代硫酸钠而导致测定结果偏大。(2分)
(4)0.06410% (3分)
16.(8分)
----化学.files/image034.gif) (1)
(1分) CO(NH2)2 (1分)
(1)
(1分) CO(NH2)2 (1分)
(2) N2+Al2O3+----化学.files/image035.gif)
----化学.files/image036.gif) 3CO+2AlN (2分)
3CO+2AlN (2分)
(3) AlN+OH-+H2O =AlO----化学.files/image038.gif) +NH3↑ (2分)
+NH3↑ (2分)
(4) ④⑦ (2分)
17.(8分)
(1)温度较低(2分)
(2)AC(2分)
(3)2Fe3+ + 3ClO- + 10 OH- = 2FeO4-+ 3Cl-+ 5H2O (2分)
(4)B、D(2分)
18.(10分)
(1)CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g)
△H=一867 kJ?mol一1 (2分)
(2) Na2S+2H2O----化学.files/image040.gif) S↓+H2↑+2NaOH (2分) 或S2-+2H2O
S↓+H2↑+2NaOH (2分) 或S2-+2H2O----化学.files/image040.gif) S↓+H2↑+2OH-
S↓+H2↑+2OH-
(3)Ksp(HgS)<Ksp(FeS) (2分) 因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附悬浮杂质而净化水(2分)
(4)尿素法成本低,节约能源。(2分)
----化学.files/image041.gif) 19.(12分)
19.(12分)
(1) (2分)
(2) 3种 (2分)
(3) 6 (2分)
(4)A: ----化学.files/image043.jpg) (2分)
② 过氧化物、HBr(1分)
(2分)
② 过氧化物、HBr(1分)
----化学.files/image045.jpg) |
B: (2分) ④ 浓硫酸(1分)
20.(10分)
(1)不能 (1分) BaCO3会与胃酸反应产生Ba2+使人中毒 (2分) 或说由于存在溶解平衡:BaCO3(s) ----化学.files/image047.gif) Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
(2)BaSO4(s)----化学.files/image048.gif) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
C(Ba2+)=1.1×10-10/0.36 =3.1×10-10 < 2×10-3mol?L-1
可以有效除去Ba2+ (3分)
(3)Ba2+ ~ BaCrO4 ~----化学.files/image050.gif) Cr2O72-~
Cr2O72-~----化学.files/image052.gif) I2~ 3S2O32-
I2~ 3S2O32-
1mol 3mol
36.00×0.100×10-3mol
c(Ba2+)----化学.files/image054.gif) mol?L-1
(4分)
mol?L-1
(4分)
四、选做题(本题包括1小题,共12分)
21.(12分)
(1)1s22s22p63s23p63d104s24p1 (2分)
(2)ACD (2分)
(3)非极性分子(2分) 三角锥 (2分) sp2 (2分)
(4)NH3分子间能形成氢键,而AsH3分子间不能形成氢键 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com