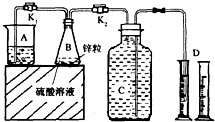
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
| 实验序号 |
硫酸浓度 |
饱和硫酸铜溶液体积/mL |
反应达到平稳的时间/min |
第1分钟收集氢气体积/mL |
第2分钟收集氢气体积/mL |
第3分钟收集氢气体积/mL |
… |
| 1 |
20% |
0 |
5.4 |
6.1 |
11.9 |
13.7 |
… |
| 2 |
20% |
0.5 |
2.5 |
23.9 |
32.1 |
33.5 |
… |
| 3 |
30% |
0.5 |
1.1 |
60.7 |
89.9 |
90.1 |
… |
| 4 |
a% |
3.0 |
0.8 |
55.7 |
66.0 |
61.4 |
… |
请回答:
(1)关闭K
2、打开K
1,观察到
,说明B反应达到平稳.
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
.
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
的水时,则V=
[与b的代数关系式,气体摩尔体积是Vm(mL?mol
-1)].
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
(填选项).
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(填实验序号).
(6)从实验后的废液中回收皓矾(ZnSO
4?7H
2O)所需的实验操作步骤是
、蒸发浓缩、
、过滤、洗涤、凉干.
(7)查资料得知:Cu
++Cl
-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
.

 .
.

 所示),写出B的结构简式
所示),写出B的结构简式





 )的相对分子质量相等,但不能与Na2CO3反应放出CO2,1mol A与足量的钠反应可产生22.4L H2(标准状况),则A的结构简式为
)的相对分子质量相等,但不能与Na2CO3反应放出CO2,1mol A与足量的钠反应可产生22.4L H2(标准状况),则A的结构简式为 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表: