
题目列表(包括答案和解析)
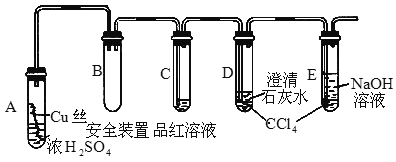
(湖北黄冈中学)某研究性学习小组为研究Cu与浓 的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%浓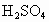 、品红溶液、澄清石灰水、
、品红溶液、澄清石灰水、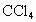 、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓
、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓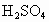 中,另一端露置在液面上方.
中,另一端露置在液面上方.
以下是该学习小组部分交流记录及后续探究实验的记录.

根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是__________________;D、E两支试管中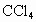 的作用是________.
的作用是________.
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失.写出淡黄色固体消失的化学反应方程式:___________.
(3)对A试管中的浓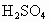 和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于
和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于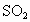 溶解度较大,生成了
溶解度较大,生成了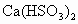 的缘故.请你设计实验验证学生1的猜想_______________________________________________.
的缘故.请你设计实验验证学生1的猜想_______________________________________________.
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____________________.(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想是:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性.
你的猜想是:_______________________________.
请你设计一个简单的实验以验证你的猜想:
______________________________________________.

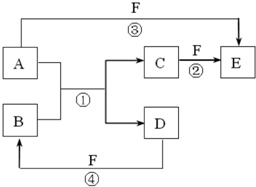 (2011?湖北模拟)A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
(2011?湖北模拟)A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| ||
(10分)下图中每一方框中的字母代表一种反应物或生成物。已知:A、B、C、D均为前三周期元素的单质,也是中学化学教材中常见的物质。其中A、B为固体,且B是良好的半导体材料,C、D为气体,电解H的饱和溶液生成x、C和D,此反应是一个重要的化工反应(物质间相互转化时参加反应或生成的H2O已略去)
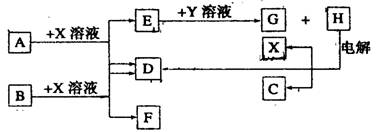
(1)B单质为 .列举B的氧化物的一种重要的工业用途为 。
(2)X的电子式为 ,Y是(填化学式) 。
(3)E和G在水溶液中混合反应,其离子反应方程式为
。
若在E的水溶液中通入过量的CO2,其离子反应方程式为
。
(4)25℃时用石墨电极电解含0.2 mol H的水溶液,在阳极产生0.2 mol气体时,测得此时溶液的体积为200 mL,则该溶液中C(OH-)最接近的数值为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com