
题目列表(包括答案和解析)
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: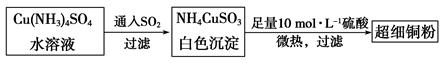
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②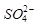 的空间构型为_____________,
的空间构型为_____________,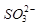 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 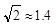 ,列式并计算结果)。
,列式并计算结果)。
 ?
?| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理.简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)=_______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应 ② CuO不干燥
③CuO中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________和_________达到实验目的。
大多金属碳化物能与水剧烈反应,生成相应氢氧化物和气态烃,如:
Na4C+4H2O→4NaOH+CH4↑, MgC2+2H2O→Mg(OH)2+C2H2↑
现有CaC2与某常见金属碳化物A的混合物,与足量盐酸反应,得一澄清溶液,并有大量气体产生,将气体通过碱石灰干燥除杂后,测其体积为V1,将所得气体充分燃烧,生成的CO2的体积为V2,相同条件下,V1:V2=5:7:向澄清溶液中逐渐加入足量Na2CO3溶液后,再继续加入NaOH溶液,沉淀物质的量变化如下图所示,试回答下列问题:
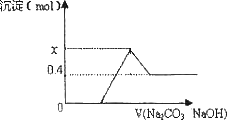
(1)已知A中的金属元素是短周期元素,则该元素是:________(写元素符号),写出CaC2与浓盐酸反应的化学方程式:________;
(2)根据Vl∶V2=5∶7,可算出混合烃中平均每Imol烃分子含有________molC,由此可知气态混合烃中含有乙炔和________,
(3)A的化学式为________;
(4)原混合物中CaC2的物质的量为________mol,A的质量为________g.

| ||
| ||
| 18a |
| b |
| 18a |
| b |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com