
题目列表(包括答案和解析)
根据元素周期律及晶体结构与性质判断,下列各项叙述中正确的组合是( )
①同一主族元素,原子半径越大,非金属单质的熔点一定越高
②同一周期元素的原子,半径越大越容易失去电子
③同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④若X是原子晶体,Y是分子晶体,则熔点:X>Y
⑤若A2+2D―=2A―+D2,则还原性:D―>A―
⑥若R2―和M+的电子层结构相同,则原子序数:R>M
⑦若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
⑧VIA族元素的氢化物中稳定性最好的,其沸点也最高
A.①③⑤⑦ B.②④⑥⑧ C.①②③④⑥⑦⑧ D.①②④⑤⑦⑧
下图是元素周期表的框架

(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
下图是元素周期表的框架
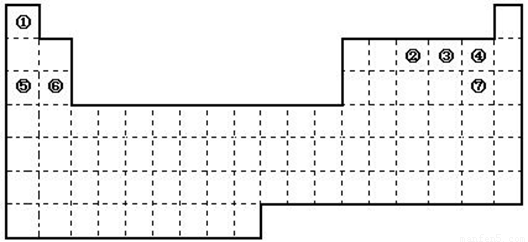
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
下图是元素周期表的框架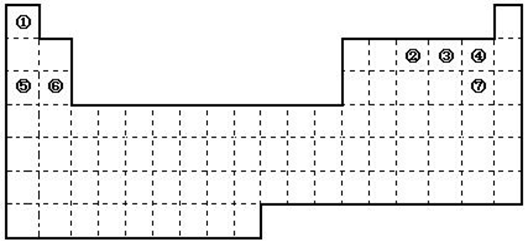
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
A.金属元素的最高价氧化物对应的水化物都是碱
B.ⅥA族元素的氢化物中稳定性最好的,其沸点也最高
C.同一主族的元素,原子半径越大其单质的熔点越高
D.全部由非金属元素形成的化合物不可能是离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com