
题目列表(包括答案和解析)
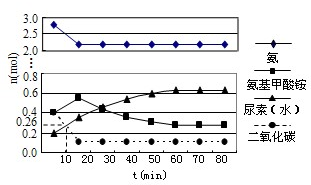
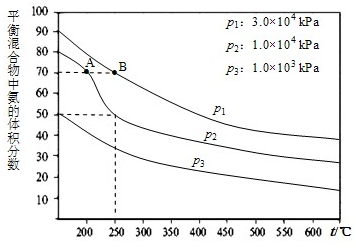 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.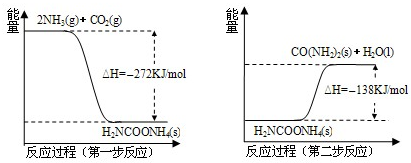
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH>0
2Fe(s)+3CO2(g) ΔH>0
①该反应的平衡常数表达式为:K=________.
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11
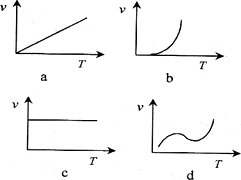
.2 g.则10 min内CO的平均反应速率为________.(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应.下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________.
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
________Fe(OH)3+________ClO-+________□=________FeO42-+________Cl-+________□;
(4)若将a g Fe和Al的混合物溶于2 mol/L的足量的硫酸中,再往溶液中加入足量的6 mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为________.
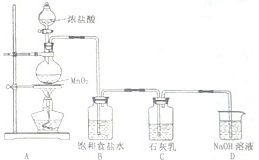 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
| ||
| ||
| ||
| ||
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.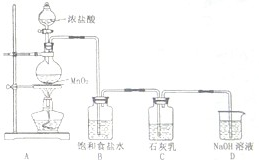
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com