
题目列表(包括答案和解析)
| HA | H2B | HC | MOH | H2O | ||
| Ka | Ka1 | Ka2 | Ka | Kb | Kw | |
| 数值 | 1.8×10-5 | 4.3×10-7 | 5.6×10-11 | 4.9×10-10 | 1×10-6 | 1×10-14 |
下列说法正确的是
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)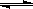 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L‾1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等。
 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)
| ||
| B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 | ||
| C.室温下,将浓度为0.1mol.L ̄1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 | ||
| D.电解精练铜时,阳极泥中常含有金属金、银、锌等 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com