
题目列表(包括答案和解析)
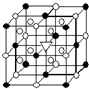 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
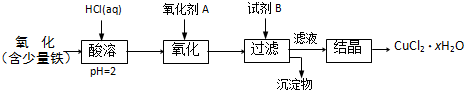
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
A.E.H是中学化学常见的单质;B.D.F是中学化学常见的氧化物,其中D又是生命活动不可缺少的液态物质;G.I的焰色反应呈黄色,D与 E在高温条件下能发生反应。它们之间的转化关系如下图所示:
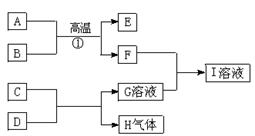
(1)C若为单质,其与D反应的离子方程式为_。C若为氧化物,其电子式为:
(2)若B为铁的氧化物,8g B灼热后通入足量CO,将生成的气体通入过量石灰水,生成沉淀15g,则B的化学式__,写出①的化学方程式 。
(3)E与D反应的化学方程式 。
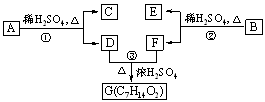
a.b.c.d.e.f.g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示)
(3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com