
题目列表(包括答案和解析)
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是
________________________________________________________________________。
(2)如何检验铁片已经洗净
________________________________________________________________________
________________________________________________________________________。
(3)该小组的实验数据记录及数据处理如下,完成下列表格。(锌的密度为7.14 g/cm3)
|
|
数据记录 |
数据处理 |
||||
|
镀锌铁皮 |
长度/cm |
宽度/cm |
镀锌铁皮质量/g |
铁皮质量/g |
锌镀层厚度(单侧)/cm |
锌镀层平均厚度(单侧)/cm |
|
A |
5.00 |
4.90 |
4.460 |
4.313 |
4.201×10-4 |
|
|
B |
5.10 |
5.00 |
4.421 |
4.267 |
4.229×10-4 |
|
|
C |
5.20 |
5.00 |
4.640 |
4.467 |
4.660×10-4 |
计算镀锌铁皮锌镀层平均厚度(单侧)________cm。本实验中产生误差的地方可能有哪些(任意列举两
种)________________________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
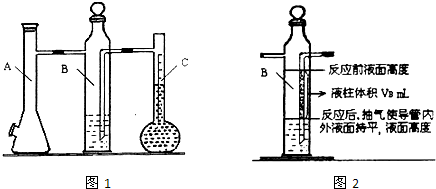
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中。回答下列问题。

(4)装置中导管a的作用是
________________________________________________________________________
________________________________________________________________________。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是
____________________________________________________(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件下的气体摩尔体积为Vm L·mol-1)。则镀锌铁皮的厚度为
________________________________________________________cm。(写出数学表达式)
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol?L―1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面实验。
![]()
(1)锌镀层完全反应的标志是 。
![]()
(2)如何检验铁片已经洗净 。
![]()
(3)该小组的实验数据记录及数据处理如下,完成下列表格(锌的密度为7.14g/cm3)
| 数据记录 | 数据处理 | ||||
镀锌铁皮 | 长度
| 宽度
| 镀锌铁皮质量/g | 铁皮
| 锌镀层厚度
| 锌镀层平均厚度(单侧)/cm |
A | 5.00 | 4.90 | 4.460 | 4.313 | 4.201×10―4 |
|
B | 5.10 | 5.00 | 4.421 | 4.267 | 4.229×10―4 | |
C | 5.20 | 5.00 | 4.640 | 4.467 | 4.660×10―4 | |
计算镀锌铁皮锌镀层平均厚度(单侧) cm。本实验中产生误差的原因可能有哪些(任意例举两种) 、
方案二:已知锌与强碱溶液反应离子方程式为:Zn+2OH―+2H2O=[Zn(OH)4]2―+H2↑。某同学按右图装置设 计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6mol?L―1 NaOH溶液中。回答下列问题:
计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6mol?L―1 NaOH溶液中。回答下列问题:
(4)装置中导管a的作用是 。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是 (填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件的气体摩尔体积为Vm mol?L―1)。则镀锌铁皮的厚度为 cm。(写出数学表达式)
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 |
若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中,滴加 |
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com