
题目列表(包括答案和解析)
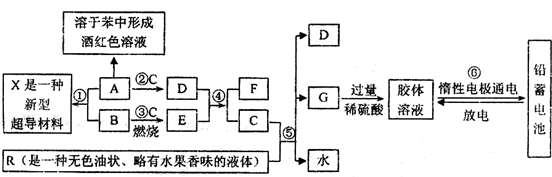
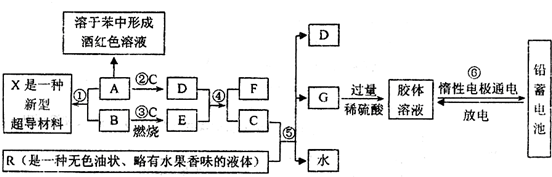
下列框图表示某些物质之间的相互转化关系。其中A是一种灰黑色固体单质、有金属光泽,1mol A能与60mol C恰好完全反应,1mol A与3mol B化合形成X:E是一种供氧剂,其阳离子与阴离子的质量之比为39:32;F在无色火焰上灼烧时透过蓝色钴玻璃观察可以看到淡紫色。R是一种传统的汽油添加剂(现已被普遍禁用),R与C完全反应生成D、G与水,且D、G、水的物质的量之比为8:1:10。试根据图中所揭示的信息回答下列问题:
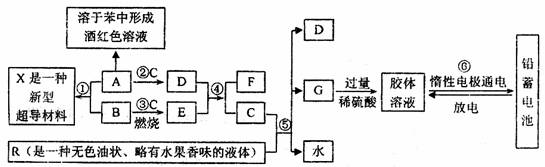
(1)A、R、X的化学式依次分别为 ; ; ;
(2)D与E反应生成F和C的化学方程式为 ,反应中每生成1mol C转移 mol电子;
(3)R被普遍禁用,主要是因为 ;
(4)⑥中电池充电时的阴极反应式为:
放电时正极反应为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com