
题目列表(包括答案和解析)
①2Fe+3Cl2![]() 2FeCl3
2FeCl3
②Fe+S![]() FeS
FeS
③Na2S+I2====2NaI+S
则Cl2、S、I2的氧化性由强到弱的顺序为( )
A.Cl2、I2、S B.Cl2、S、I2 C.S、I2、Cl2 D.I2、Cl2、S
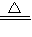 2FeCl3(或H2S+Cl2═S↓+2HCl)
2FeCl3(或H2S+Cl2═S↓+2HCl)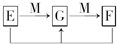
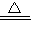 2FeCl3(或H2S+Cl2═S↓+2HCl)
2FeCl3(或H2S+Cl2═S↓+2HCl)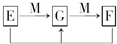
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中:Fe+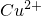 =Cu+Fe2+ =Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+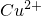 =Cu+2Na+ =Cu+2Na+ |
| B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性:2H++S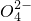 +Ba++2OH-=BaSO4↓+2H2O +Ba++2OH-=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性:2H++S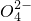 +Ba++2OH-=BaSO4↓+2H2O +Ba++2OH-=BaSO4↓+2H2O |
| C | 铁和氯气反应2Fe+3Cl2 2FeCl3 2FeCl3 | 铁和单质反应2Fe+3I2 2FeI3 2FeI3 |
| D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com