
题目列表(包括答案和解析)
(6分)下列七种晶体:A.二氧化硅 B.乙烷晶体 C.碳酸钠 D.氯化钠 E.晶体氩
F.过氧化氢 G.镁 (用字母填空)
(1)由原子直接构成的分子晶体是__________。
(2)含有非极性键的分子晶体是____________,含有离子键、共价键的化合物是___________。
(3)在一定条件下能导电且导电时未发生化学反应的是______________,受热熔化需克服共价键的是__________________,受热熔化后化学键不发生变化的是__________。
(11分)
2-1 画出2,4-戊二酮的钠盐与Mn3+形成的电中性配合物的结构式(配体用 表示)。
表示)。
2-2 已知该配合物的磁矩为4.9玻尔磁子,配合物中Mn的未成对电子数为 。
2-3 回答:该化合物有无手性?为什么?
2-4 画出2,4戊二酮负离子的结构简式(必须明确其共轭部分),写出其中离域π键的表示符号。
2-5 橙黄色固体配合物A的名称是三氯化六氨合钴(Ⅲ),是将二氯化钴、浓氨水、氯化铵和过氧化氢混合,以活性炭为催化剂合成的。机理研究发现,反应过程中首先得到Co(NH3)62+离子,随后发生配体取代反应,得到以新配体为桥键的双核离子B4+,接着发生桥键断裂,同时2个中心原子分别将1个电子传递到均裂后的新配体上,得到2个C2+离子,最后C2+离子在活性炭表面上发生配体取代反应,并与氯离子结合形成固体配合物A。写出合成配合物A的总反应方程式;画出B4+和C2+离子的结构式。
总反应方程式:
B4+和C2+离子的结构式:
已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素。)如下图,则下列判断中正确的是 ( )
(E) (G) (L) (M)
| A.常温常压下,L是一种液态有机物 | B.E是一种含有非极性键的分子 |
| C.干燥的G 能漂白有色物质 | D.上述反应的类型是取代反应 |
(11分)
2-1 画出2,4-戊二酮的钠盐与Mn3+形成的电中性配合物的结构式(配体用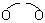 表示)。
表示)。
2-2 已知该配合物的磁矩为4.9玻尔磁子,配合物中Mn的未成对电子数为 。
2-3 回答:该化合物有无手性?为什么?
2-4 画出2,4戊二酮负离子的结构简式(必须明确其共轭部分),写出其中离域π键的表示符号。
2-5 橙黄色固体配合物A的名称是三氯化六氨合钴(Ⅲ),是将二氯化钴、浓氨水、氯化铵和过氧化氢混合,以活性炭为催化剂合成的。机理研究发现,反应过程中首先得到Co(NH3)62+离子,随后发生配体取代反应,得到以新配体为桥键的双核离子B4+,接着发生桥键断裂,同时2个中心原子分别将1个电子传递到均裂后的新配体上,得到2个C2+离子,最后C2+离子在活性炭表面上发生配体取代反应,并与氯离子结合形成固体配合物A。写出合成配合物A的总反应方程式;画出B4+和C2+离子的结构式。
总反应方程式:
B4+和C2+离子的结构式:
已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子M。(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素。)如下图,则下列判断中正确的是 ( )

(E) (G) (L) (M)
A.常温常压下,L是一种液态有机物 B.E是一种含有非极性键的分子
C.干燥的G 能漂白有色物质 D.上述反应的类型是取代反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com