
题目列表(包括答案和解析)
(16分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
① 若X和Y均为惰性电极,a为CuSO4溶液,则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。

(1)写出甲池中正极的电极反应式:____________________________________________。
(2)写出乙池中负极的电极反应式:____________________________________________。
总反应的离子方程式为_____________________________________________________。
(3)如果甲与乙同学认为“构成原电池的材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_________活泼性更强,而乙会判断出_________活泼性更强(写元素符号)
(4)由实验,可得到如下哪些正确的结论( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验证明金属活动顺序表已过时,没有实用价值
D.该实验说明化学研究对象复杂,反应条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这一种做法_________(填“可靠”或“不可靠”)。如不可靠,提出另一个判断原电池正负极的可行实验方案____________________________________________________________________(如可靠,可不填写)。
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
(10分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
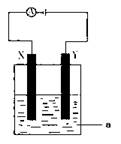
① 若X和Y均为惰性电极,a为CuSO4溶液,
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
(20分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

① 若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为 ,电解时的化学反应方程式为 ,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做 ,电镀液的浓度 (填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com