
题目列表(包括答案和解析)
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:① CH4(g)+H2O (g)=CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g)
△H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是: [Cu(NH3)2]Ac
+ CO + NH3  [Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)3]Ac·CO
△H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。0<V≤44.8 L时,电池总反应方程式为 。
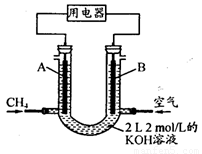
② 44.8 L<V≤89.6 L时,负极电极反应为 。
③ V=67.2 L时,溶液中离子浓度大小关系为 。
(14分)氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K=
②试判断K1 K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是 。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)= , 以NH3表示该过程的反应速率v(NH3)= 。
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO(g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① O<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③V=67.2 L时,溶液中离子浓度大小关系为 。
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。

① O<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V=67.2 L时,溶液中离子浓度大小关系为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com