
题目列表(包括答案和解析)
合成氨的热化学方程式为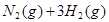
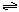

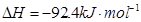 。现
。现
将1mol 3mol
3mol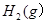 充入一容积为2L的密闭容器中,在500℃下进行反应,10min
充入一容积为2L的密闭容器中,在500℃下进行反应,10min
时达到平衡,NH3的体积分数为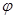 ,下列说法中正确的是( )
,下列说法中正确的是( )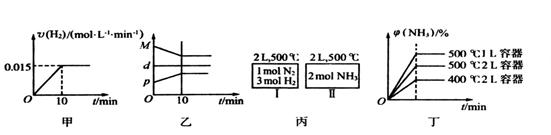
| A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为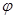 ,则容器I放出热量与容器II吸收热量之和为92.4kJ ,则容器I放出热量与容器II吸收热量之和为92.4kJ |
| D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)

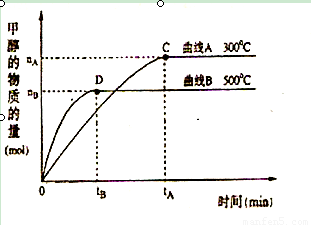
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
合成氨的热化学方程式为
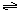
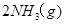
 。现
。现
将1mol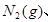 3mol
3mol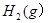 充入一容积为2L的密闭容器中,在500℃下进行反应,10min
充入一容积为2L的密闭容器中,在500℃下进行反应,10min
时达到平衡,NH3的体积分数为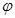 ,下列说法中正确的是( )
,下列说法中正确的是( )
A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为 ,则容器I放出热量与容器II吸收热量之和为92.4kJ
,则容器I放出热量与容器II吸收热量之和为92.4kJ
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)
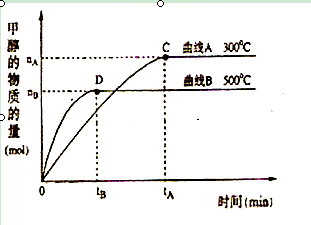
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
D
D
A
B
D
D
C
D
B
B
B
C
C
A
C
C
B
A
19.(8分)( 1 ) B D ( 2 分)
(2)一定有 NO3-、Al3+、SO42-(2分); 一定无 Fe3+、Ba2+、HCO3-(2分)
(3) Al3+ + 3 NH3?H2O = Al(OH)3↓+3NH4+ (2分)
 20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
|