
题目列表(包括答案和解析)
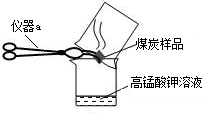
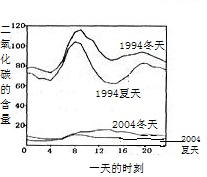
| ||
| ||
 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
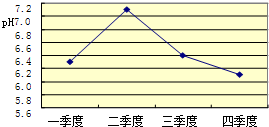
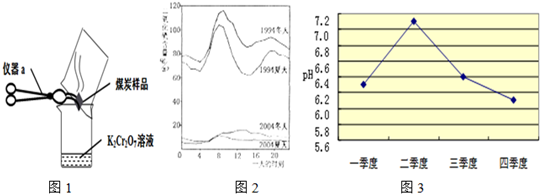
| ||
| ||
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
 【资料卡片】:
【资料卡片】:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物。
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 ▲ 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由。 ▲ ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象。资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ▲ ;
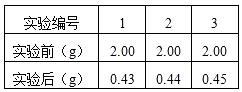
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
【实验步骤】:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至
 室温;
室温;
②转移剩余物至烧杯中,加入稀HCl,至 ▲ ;
③过滤、洗涤、称量得到剩余固体质量(如右表);
④根据实验数据进行计算。
【数据处理】:
(4)此测定做3次实验的目的是 ▲ ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数。(2分) ▲ ;
【实验分析】:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ▲ ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 ▲ ;
(8)步骤②中,加稀HCl发生的反应有 ▲ 、 ▲ ;
(9)步骤③中,洗涤的目的是 ▲ ;若不洗涤,则测定结果将 ▲ 。(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 ▲ 洗涤。
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
 【资料卡片】:
【资料卡片】:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物。
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 ▲ 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由。 ▲ ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象。资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ▲ ;
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
【实验步骤】:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至
 室温;
室温;
②转移剩余物至烧杯中,加入稀HCl,至 ▲ ;
③过滤、洗涤、称量得到剩余固体质量(如右表);
④根据实验数据进行计算。
【数据处理】:
(4)此测定做3次实验的目的是 ▲ ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数。(2分) ▲ ;
【实验分析】:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ▲ ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 ▲ ;
(8)步骤②中,加稀HCl发生的反应有 ▲ 、 ▲ ;
(9)步骤③中,洗涤的目的是 ▲ ;若不洗涤,则测定结果将 ▲ 。(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 ▲ 洗涤。
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
[资料卡片]:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由. ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ;
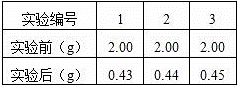
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
[实验步骤]:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至 ;
③过滤、洗涤、称量得到剩余固体质量(如表);
④根据实验数据进行计算.
[数据处理]:
(4)此测定做3次实验的目的是 ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数. ;
[实验分析]:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 、、 ;
(8)步骤②中,加稀HCl发生的反应有 、 ;
(9)步骤③中,洗涤的目的是 ;若不洗涤,则测定结果将 .(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 洗涤.
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com