
题目列表(包括答案和解析)
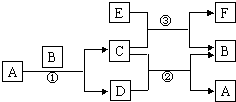 图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质.反应①②是置换反应,反应①②③均在高温下进行.A在常温下为液态,C有磁性,E与强碱溶液反应可产生H2,F是既能溶于NaOH又能溶于HCl的氧化物.
图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见的物质.反应①②是置换反应,反应①②③均在高温下进行.A在常温下为液态,C有磁性,E与强碱溶液反应可产生H2,F是既能溶于NaOH又能溶于HCl的氧化物.| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | J | k |


| C(mol/L)时间(s) | O | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| n(mol) 时间(s) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| 族 周期 |
IA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | |||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com