
题目列表(包括答案和解析)
| (w2-w1)×112×10 |
| 160a |
| (w2-w1)×112×10 |
| 160a |

| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
| ||
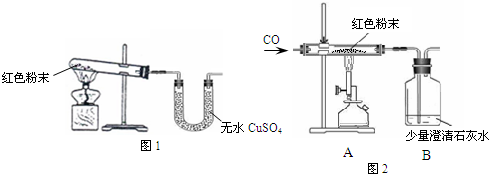
| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 |
洗气瓶和所盛溶液 的总质量为180.0g |
洗气瓶和瓶中物质 的总质量为183.1g |
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250 mL溶液;
③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过
请根据上面叙述,回答:
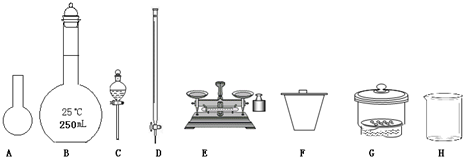
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和__________(填字母)。

(2)写出步骤③中发生反应的离子方程式___________________________________。
(3)洗涤是洗去附着在沉淀上的_____(写离子符号),洗涤沉淀的操作是_________________。
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为_______。
(5)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确_______(填正确或错误),请说明理由:____________________。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
一、选择题(本题包括18小题,每小题2分,共36分)
1
2
3
4
5
6
7
8
9
B
D
B
B
A
D
B
C
A
10
11
12
13
14
15
16
17
18
D
A
C
B
A
D
D
B
C
二、填空题(本题包括6小题,共64分)
(2)
(3) ①如2Na+2H2O = 2Na++2OH-+H2↑;
②如H++NH3×H2O = NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
20.(10分)(1)铼元素在自然界的存在分散,矿石中含量低,难于富集;铼元素与其他元素共存,难以分离(4分)(2)222(2分)
21.(8分)(1)吸热(2)1/9,1/7(3)2NO+O2+4CO = 4CO2+N2
22.(16分)(每空2分)(1)Al(OH)3+OH-=AlO2-+2H2O (2)
(3)①酸 ② Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+2HCl (5)HCl>H2S
(6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq) △H= -4QkJ/mol
23.(12分)步骤一:(1)①正 (1分);②Cu2++2e = Cu (2分);(2)变小(1分)
步骤二:(一)①3Ag + 4H+ + NO3― = 3Ag+ + NO↑+ 2H2O(2分);
②浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4―离子,使反应2平衡向右移动,则金溶于王水中。(2分)(二)①0.5 (2分);②0.1(2分)
24.(8分)(每空2分)(1) 10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
(2) 5 (3)Ⅰ < ; Ⅱ 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com