
题目列表(包括答案和解析)
(11分)短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
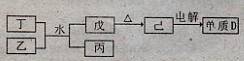
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
(2)已知E及其化合物有以下变化:
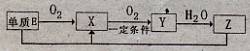
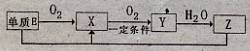
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
(11分)短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
(11分)短周
 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化: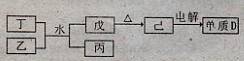
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
(2)已知E及其化合物有以下变化: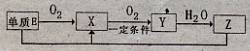
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留, 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
(1)已知相关物质之间存在如下变化:
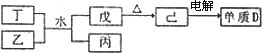
①丁与乙和水反应生成戊和丙的离子方程式为________,由物质已电解得到单质D的化学方程式为________;
②0.1 moL/L的丙溶液中所含离子浓度由大到小排列顺序为________.
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式________.
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为________(任写一个即可).
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2 L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________.

 期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。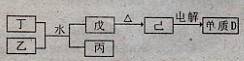
 所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。一、选择题(本题包括18小题,每小题2分,共36分)
1
2
3
4
5
6
7
8
9
B
D
B
B
A
D
B
C
A
10
11
12
13
14
15
16
17
18
D
A
C
B
A
D
D
B
C
二、填空题(本题包括6小题,共64分)
(2)
(3) ①如2Na+2H2O = 2Na++2OH-+H2↑;
②如H++NH3×H2O = NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
20.(10分)(1)铼元素在自然界的存在分散,矿石中含量低,难于富集;铼元素与其他元素共存,难以分离(4分)(2)222(2分)
21.(8分)(1)吸热(2)1/9,1/7(3)2NO+O2+4CO = 4CO2+N2
22.(16分)(每空2分)(1)Al(OH)3+OH-=AlO2-+2H2O (2)
(3)①酸 ② Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+2HCl (5)HCl>H2S
(6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq) △H= -4QkJ/mol
23.(12分)步骤一:(1)①正 (1分);②Cu2++2e = Cu (2分);(2)变小(1分)
步骤二:(一)①3Ag + 4H+ + NO3― = 3Ag+ + NO↑+ 2H2O(2分);
②浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4―离子,使反应2平衡向右移动,则金溶于王水中。(2分)(二)①0.5 (2分);②0.1(2分)
24.(8分)(每空2分)(1) 10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
(2) 5 (3)Ⅰ < ; Ⅱ 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com