
题目列表(包括答案和解析)
(1)写出各元素的符号:
X___________,Y___________,Z___________。
(2)Y单质在空气中燃烧后生成物的电子式为:___________。
(3)用电子式表示X与Y形成化合物的过程:_______________________________________。
(4)用电子式表示X与氢形成化合物的过程:_______________________________________。
X、Y、Z三种元素,已知X元素的气态氢化物化学式为H2X,该氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17∶40,X原子核内质子数与中子数相等,Y与X可形成离子化合物Y2X,Y的阳离子的电子层结构与Ne相同。Z与X处于同一主族,其单质是气态双原子分子。试完成下列问题:
(1)写出各元素的符号:
X___________,Y___________,Z___________。
(2)Y单质在空气中燃烧后生成物的电子式为:___________。
(3)用电子式表示X与Y形成化合物的过程:_______________________________________。
(4)用电子式表示X与氢形成化合物的过程:_______________________________________。
 X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题:
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素.回答下列问题: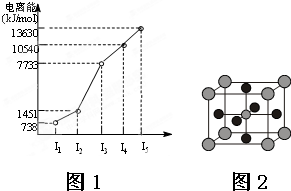
选择题答案
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
D
C
C
D
D
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
D
A
C
C
B
A
D
A
21(5分). (1) (2分) ① ④ (每空1分)
(2)(3分)
1 Na2Cr2O7+ 6 KI+ 14 HCl→ 2 CrCl3+2 NaCl+ 6 KCl+ 3 I2+ 7 H2O (2分)
电子转移(略) (1分)
22(6分)、(1) Cl2 Ca(OH)2 (2分)
(2)MnO2+4H++2Cl-=Mn2++Cl2+2H2O (2分)
(3)C+2H2SO4(浓)=CO2+SO2+2H2O (2分)
23(9分)、(1)A:碳(或C)(1分) C:钠(或Na)(1分)
(2) Na2S电子式(略) (1分) 离子键和非极性键(2分)
(3)2CO2+2Na2O2=2Na2CO3+O2 (2分)
(4)Na2O2+S2-+2H2O=4OH-+S↓+2Na+ (2分)
24(8分)、KAl(SO4)2?12H2O BaSO4 NaAlO2 AlCl3(每空1分,共4分)
(1)(2分)Al3++3H2O A(OH)3+3H+(2)(2分)Al(OH)3+OH-=AlO2-+2H2O
A(OH)3+3H+(2)(2分)Al(OH)3+OH-=AlO2-+2H2O
25.(14分)(1)(3分)1:2 (1分) 使氧气过量,提高SO2的转化率(2分)
(2)(3分)该反应是放热的可逆反应,温度过高平衡逆向移动,不利于 的生成,且影响催化剂的活性。
的生成,且影响催化剂的活性。
(3)(3分)向锥形瓶中滴加 溶液,直至沉淀量不再增加(或静置后向上层清液中滴入
溶液,直至沉淀量不再增加(或静置后向上层清液中滴入 溶液,若产生沉淀,继续加入
溶液,若产生沉淀,继续加入 溶液后,重复上述过程至清液中不再产生沉淀)(2分) c(1分)
溶液后,重复上述过程至清液中不再产生沉淀)(2分) c(1分)
(4)(5分)
a d (2分) 
26.(8分)(1)①6 ②MgCO3和NaHCO3;KHCO3和CaC03(2)0.200 (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com