
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
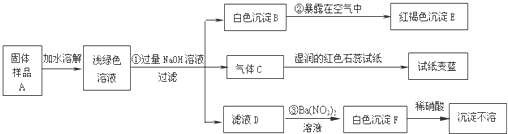
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 | 稀硫酸与氢氧化钠溶液能发生反应 |
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |

| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑。已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。![]()
实验用到的主要装置为: 装置连接顺序为: 。(填写编号)

(2)操作步骤及数据处理:
第一步 检查气密性;
第二步 装入药品,称取装置①和③的质量;
第三步 试验后再次称取装置①和③的质量,记录数据如下;
根据以上数据可得产生的水和二氧化碳的质量之比为 。(要求写出最简整数比)
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些?
A.二氧化碳没有被完全吸收 B.水没有被完全吸收 C.碱式碳酸铜药品中含有水分 D.碱式碳酸铜没有完全分解

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com