
题目列表(包括答案和解析)
 某化学小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
某化学小组对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.| 加入试剂 | 现象 | 结论 |
| 取少量固体于试管中,加入稀盐酸 | 有气泡产生,固体全部溶解,溶液变为浅绿色 有气泡产生,固体全部溶解,溶液变为浅绿色 |
猜想②正确 |
有气泡产生,固体部分溶解,溶液变为浅绿色 有气泡产生,固体部分溶解,溶液变为浅绿色 |
猜想③正确 |
| ||
| ||
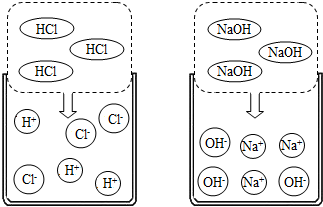 某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.
某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有________生成,滤液为蓝色 |
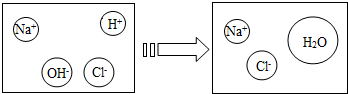

| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有______生成,滤液为蓝色 |



| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. | 没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. | 有______生成,滤液为蓝色 |

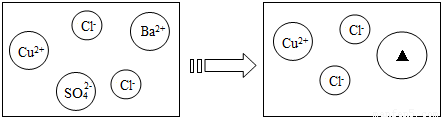

 24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.
24、某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分解反应进行再探究.| 实验步骤 | 实验现象 | 实验结论 |
| 编号 | 实验 | 现象 |
| 1 | 向盛有CuSO4溶液的试管里加入适量的 NaCl溶液. |
没有明显变化,溶液仍为蓝色 |
| 2 | 向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液. |
有 白色沉淀 生成,滤液为蓝色 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com