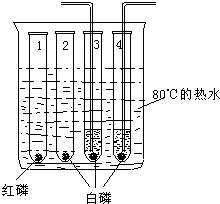
28、为了探究可燃物的燃烧条件,第2实验小组的同学查阅资料得知:白磷为蜡状固体,有剧毒,不溶于水,着火点为40℃,红磷着火点为240℃.然后他们利用如右图所示的装置进行实验:
(1)试管1中放有红磷,试管2、3、4中放有白磷,试管3、4中加有与烧杯中的水等温的热水.他们观察到的实验现象为:
试管2中白磷燃烧,有大量白烟产生,试管1、3、4中无明显现象
.
【讨论1】比较试管1、2中的现象得知:可燃物燃烧的条件之一为
达到燃烧所需的最低温度(或温度达到着火点)
,比较试管2、3、4中的现象得知:可燃物燃烧的又一条件为
可燃物与支持燃烧的氧气(或空气)接触
.
(2)为了验证上述结论的正确性,小组成员小杨向试管3中通入氧气,向试管4中通入空气.观察到的现象为:
试管3、4中的白磷均燃烧,有大量白烟产生,且试管3中的白磷燃烧更剧烈
.
【讨论2】通过上述实验,同学们得出可燃物燃烧的条件并体会到燃烧条件缺一不可.同时还得出了另一个结论:影响燃烧剧烈程度的因素之一为
氧气的浓度
.
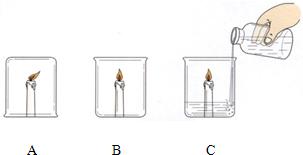
(3)如果破坏燃烧条件,使燃烧反应停止,就可以达到灭火的目的.第5小组成员李进进行了下列实验:点燃三支蜡烛,在其中一支蜡烛上扣一只烧杯;将另两支蜡烛放在烧杯中,然后向其中一只烧杯中加适量的碳酸钠和盐酸,如下图所示.请你和小李一起填写实验报告.

 28、为了探究可燃物的燃烧条件,第2实验小组的同学查阅资料得知:白磷为蜡状固体,有剧毒,不溶于水,着火点为40℃,红磷着火点为240℃.然后他们利用如右图所示的装置进行实验:
28、为了探究可燃物的燃烧条件,第2实验小组的同学查阅资料得知:白磷为蜡状固体,有剧毒,不溶于水,着火点为40℃,红磷着火点为240℃.然后他们利用如右图所示的装置进行实验: