
题目列表(包括答案和解析)

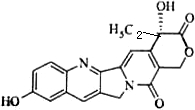 (2009?江苏)具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )
(2009?江苏)具有显著抗癌活性的10-羟基喜树碱的结构如图所示.下列关于10-羟基喜树碱的说法正确的是( )
(09江苏高考化学)下列化学实验事实及其解释都正确的是:
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4 难溶于盐酸
C.向0.1mol·L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,KMnO4 溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1 的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3 溶液, 振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com