
题目列表(包括答案和解析)
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
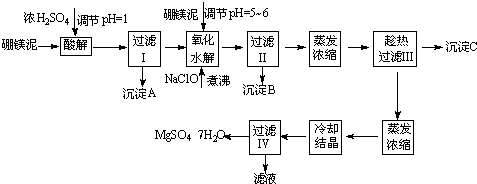
(08年广东卷)下列实验能达到预期目的的是()
A. 向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl2饱和溶液制备Fe(OH)3胶体
B. 向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C. 称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol?L-1 SnCl2溶液
D. 用氢氧化铜粉末检验葡萄糖
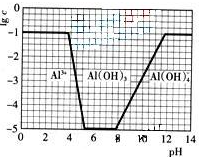 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑ Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com