
题目列表(包括答案和解析)
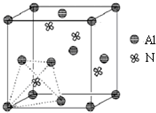
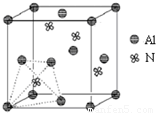
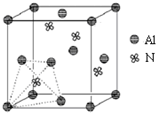 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:| 700℃ |
| 700℃ |



| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是:
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素称为过渡元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com